加藤研究室
生命理工学院
生命理工学系 生命理工学コース
脊椎動物の多様な環境適応戦略
様々な環境で生息する脊椎動物は、それぞれ異なる適応戦略により恒常性を維持しています(Ekert, Animal Physiology - Mechanisms and Adaptations, 2000)。脊椎動物の環境適応にはどの細胞機能や遺伝子進化が関与しているのでしょうか?
私たちの研究室では様々な臓器の輸送上皮細胞に発現する膜輸送体(トランスポーター、チャネル、ポンプ等)に着目し、その遺伝子構成、発現パターン、電気生理学的特性、細胞内局在、進化を解析して種間で比較しています。恒常性維持を担う分子メカニズムの共通性と多様性を明らかにし、脊椎動物が環境に適応し生息域を広げてきた歴史をゲノム・細胞レベルで理解したいと考えています。
膜輸送体
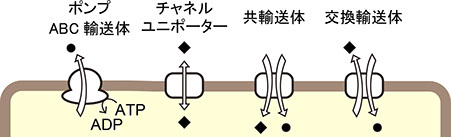
膜輸送体はそれぞれ特異的な基質の促進拡散や能動輸送を担っています。チャネル・ユニポーターは主に促進拡散を、ポンプ、共輸送体、交換輸送体は主に能動輸送を担当します。ポンプやABC輸送体はATPの加水分解によって駆動される一次性能動輸送体として、また共輸送体、交換輸送体は電気化学ポテンシャルにより駆動される二次性能動輸送体として分類されます。
脊椎動物のゲノム中には約1,200の膜輸送体遺伝子が存在することが知られています(Hediger et al., Mol Aspects Med 34: 95-107, 2013)。この数はタンパク質をコードする全遺伝子の約6%に相当し、細胞膜・細胞内膜で働く輸送体のほぼ全てが含まれると考えられます。Slcファミリーの約半数はあまり機能解析が進んでおらず、これまでの研究論文発表数が1遺伝子当たり15以下であることが指摘されています(César-Razquin et al., Cell 162:478-487, 2015)。
種間で膜輸送体遺伝子の数・構成を比較すると、基本的な遺伝子構成や遺伝子数はサメからヒトまでかなり似ていることが分かります。一方それぞれの系統や種に特異的な遺伝子重複、遺伝子欠損、遺伝子変異も数多く存在しますが、それらのほとんどは生理学的・進化学的な意義が不明なままです。
ゲノム中の1,200の膜輸送体遺伝子の発現は基本的にそれぞれ独立に制御されるので、膜輸送体遺伝子の発現パターンは細胞ごとに異なります。それぞれの細胞における膜輸送体遺伝子の発現パターンを理解することは、それぞれの細胞の細胞膜の物質透過特性(吸収活性、分泌活性)とそのメカニズムを理解する上で非常に重要になります。
脊椎動物の環境適応を考える場合、腎臓や腸の様な個体全体の恒常性維持を担う臓器の上皮細胞がどの様な膜輸送体遺伝子を発現しているか、その発現パターンが生息環境によりどの様に変化するか、個々の遺伝子産物の活性は種間でどの程度異なるか、などといった疑問が生じます。
海水魚腎臓の Mg2+, Ca2+, SO42- 排出を担う膜輸送体
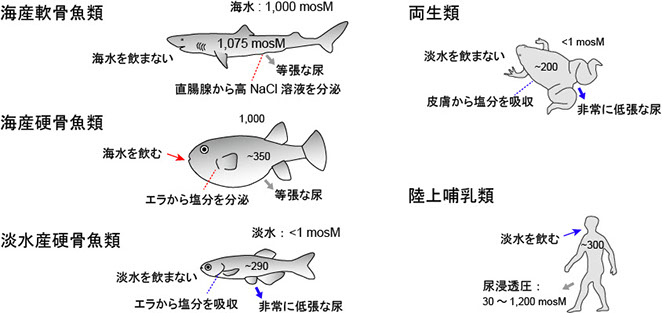
海水魚は体液の約3倍の浸透圧を持つ海水で生息するため、常に環境に水を奪われ体内に塩分が侵入してしまいます。そこで海水魚は体液浸透圧の恒常性を維持するために海水を積極的に飲み、塩分と水分を腸から吸収し、エラや腎臓、腸から余剰の塩分を排出することで体液浸透圧の上昇を防いでいます(図1)。海水にはNa+, Cl- のほか様々なイオンが含まれますが、Na+, Cl-, K+ はエラから,Mg2+, SO42-, Ca2+ などは腎臓と腸から排出することが知られています。腎臓の尿細管は様々なイオン(特に2価イオン)を含む原尿を活発に分泌することが知られており(Beyenbach, Nature 299: 54-66, 1982)、また海水魚の最終尿には驚くほど高濃度のMg2+ とSO42- が存在します(Smith, Am J Physiol 93: 480-505, 1930)。
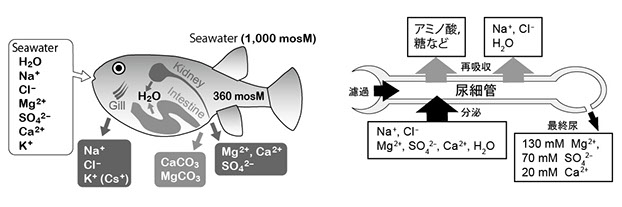
図1 海産硬骨魚の水電解質代謝と腎ネフロンの役割。
2002年、脊椎動物ではヒトに次いで2番目の種としてトラフグ(Takifugu rubripes)のゲノムがAparicioらにより解読・公開されました(Science 297: 1301-1310, 2002)。ゲノムが解読されるとその種が持つ全ての膜輸送体のリスト(候補も含めて)を作成できるので遺伝子発現解析を網羅的に行うことができます。またトラフグ近縁種のメフグ(Takifugu obscurus)は淡水と海水の両方の環境で生きることができる広塩性魚であり(Kato et al. BMC Physiol 5(18): 1-11, 2005)、漢字の「河豚」の語源となった魚としても知られます。私たちはトラフグゲノムデータを利用して膜輸送体のリストを作成し、淡水と海水でそれぞれ飼育したメフグの様々な臓器において発現比較を行いました。その結果、腎臓において様々な2価イオン輸送体遺伝子の発現量が変化することを見出しました(図2)。SO42-輸送体(Slc26a6)、Ca2+輸送体(Slc8a2)、Mg2+輸送体(Slc41a1, Cnnm3)の腎臓における発現は海水飼育時に上昇し、一方Na+-Cl-共輸送体(Slc12a3)、Mg2+輸送体(Cnnm2)の発現は淡水飼育時に上昇します。
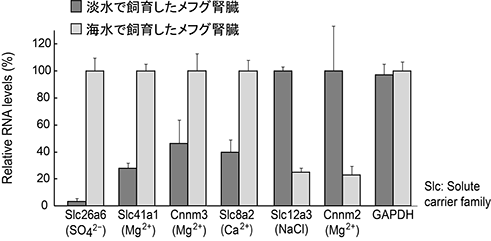
図2 メフグ腎臓における様々な膜輸送体の飼育水(淡水・海水)依存的な発現変化。
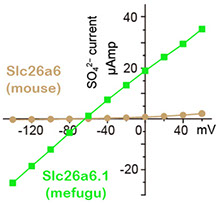
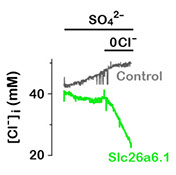
図3 メフグSlc26a6.1とマウスSlc26a6のCl-/SO4‐ 交換輸送活性の比較。Slc26a6は起電性(electrogenic)輸送体であるため、その活性は基質依存的な電流として二電極電位固定法により計測したり(左)、細胞内Cl-の濃度変化としてCl- 電極により測定したり(右下)することができます。左の図ではmouse Slc26a6の活性は低く見えますが、実際には十分に強い活性が検出できています。mefugu Slc26a6.1 の活性が「極めて」強力であることを示しています。
Slc26a6は陰イオン交換輸送体ファミリーの一員で、Cl-と様々な陰イオン(HCO3-, formate-, SO42-, oxalate2-)を交換輸送します。哺乳動物では腸や膵管におけるHCO3- の分泌、シュウ酸の排出などにおいて重要な役割を担っています(Alper and Sharma, Mol Aspects Med 34: 494-515, 2013)。フグゲノム中には複数のSlc26a6遺伝子パラログが存在し、その1つの発現が海水飼育したメフグの腸と腎臓において顕著に上昇します(Kurita et al., Am J Physiol 294: R1402-R1412, 2008)。アフリカツメガエル卵母細胞の発現系に発現させたマウスとメフグのSlc26a6の活性を同じ条件で比較すると、HCO3-, formate-, oxalate2- の輸送活性はほぼ同じです。一方SO42- 輸送活性において、メフグSlc26a6.1はマウスSlc26a6に比べて10-100倍もの強い活性を示し(図3)(Kato et al. Am J Physiol 297: R1647-1659, 2009)、これは海水魚が尿中にSO42- を排出するのに有利な性質であると言えます。海水魚腎臓から分離した刷子縁膜にはCl-/SO42-交換輸送活性が見出されており(Renfro and Pritchard, Am J Physiol 244: F488-F496, 1983)、かつSlc26a6.1も近位尿細管の刷子縁膜に局在する事から、Slc26a6.1は海水魚の主要なSO42-排出経路であると考えられます。
Slc8a2はNa+とCa2+ を交換輸送する陽イオン交換輸送体ファミリーの一員で、Na+/Ca2+ exchanger 2 (NCX2) としても知られます。Slc8a2は哺乳動物と淡水魚(ゼブラフィッシュ)では脳で発現しています。一方海水飼育したメフグやトラフグでは、Slc8a2は脳に加えて腎臓でも高発現しており、Ca2+ の尿中への排出を担っていると考えられます(Islam et al. Am J Physiol 301: R1427-1439, 2011)。
海水には約50 mMものMg2+が含まれます。海水魚の血漿Mg2+ は約 1 mMに維持されており、海水魚はMg2+を積極的に排出する必要があります。海水魚の尿には150 mMものMg2+が含まれることから、腎臓が主要な排出経路であると考えられます。淡水・海水でそれぞれ飼育したメフグの腎臓では、Mg2+輸送体ファミリーの一員であるSlc41a1とCnnm3の発現が海水飼育時に、Cnnm2の発現が淡水飼育時にそれぞれ上昇します(図1)。海水メフグ腎臓の近位尿細管細胞において、Slc41a1は原尿側細胞膜(頂端膜、apical膜)直下の細胞内小胞膜に、Cnnm3は体液側細胞膜(側底膜、basolateral膜)に局在します(図4)。海水魚腎臓の近位尿細管細胞の中にはMg2+を高濃度に含む小胞の存在することから、Mg2+排出における開口放出の関与が示唆されていました(Beyenbach, Front Biosci 5: D715-D719, 2000)。Slc41a1は細胞内小胞膜に局在しているため、細胞質から小胞内へのMg2+輸送・濃縮に関与する可能性が考えられます(図5)(プレスリリース記事1、2)。
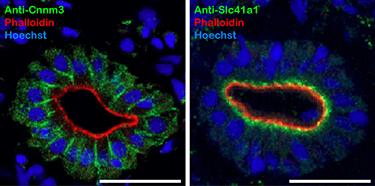
図4 海水メフグ近位尿細管におけるMg2+ 輸送体Cnnm3とSlc41a1の局在
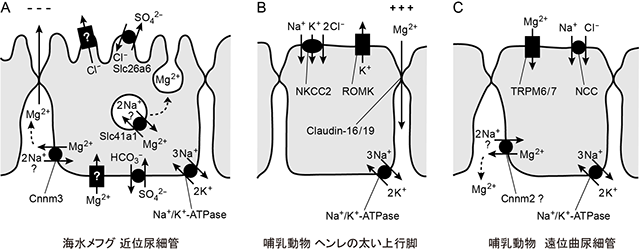
図5 Mg2+上皮輸送モデルの多様性。(左)海水メフグ近位尿細管によるMg2+排出モデル。比較のためSO42-の排出経路も書き加えた。(中央)哺乳動物のヘンレの太い上行脚によるMg2+再吸収モデル。(右)哺乳動物の遠位曲尿細管によるMg2+再吸収モデル。
淡水魚の塩分吸収、水排出を担う膜輸送体
淡水魚は塩濃度が体液の1/100以下の環境に生息するため、常に環境から体内に水が浸入します。そこで淡水魚は体液の恒常性を維持するために、体液の約1/10まで塩分を希釈した低張尿を排出することで収支として水を排出し、同時に淡水中の僅かな塩分をエラから吸収します(図1)。
淡水から体内に塩分を取り込むには、濃度勾配に逆らってイオンを吸収する仕組みが必要になります。淡水魚のエラにおいては、NH4+排出と交換にNa+を取り込む仕組み(Na+/NH4+交換輸送体)の存在が長く議論されいます。Slc9a3 (Nhe3, Na+/H+ exchanger 3) は哺乳動物の小腸や腎臓における主要なNa+ 吸収経路の一つとして知られますが(Donowitz et al., Mol Aspects Med 34:236‐251, 2013)、魚類にも相同遺伝子が存在し、その遺伝子産物が淡水魚のエラや体表に散在する塩類細胞の淡水側細胞膜(apical膜)に局在しています(Hirata et al. Am J Physiol 284: R1199-R1212, 2003; Yan et al., Am J Physiol 293: C1814-C1823, 2007)。アフリカツメガエル卵母細胞に発現させたゼブラフィッシュ由来のSlc9a3bの活性をイオン選択性電極法により解析したところ、Na+/H+ 交換輸送活性とNa+/NH4+ 交換輸送活性の測定に成功しました(図2、プレスリリース記事1、2)(Ito et al., Am J Physiol 306: R315-R327, 2014)。
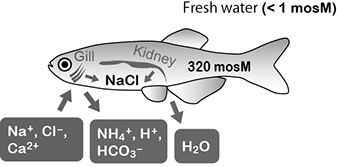
図1 淡水産硬骨魚の水電解質代謝。
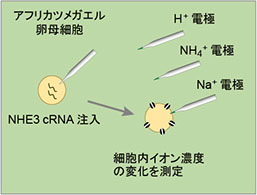
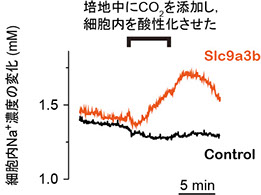
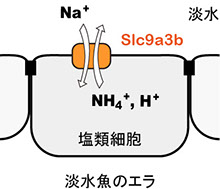
図2 アフリカツメガエル卵母細胞に発現させたSlc9a3b (Nhe3b) の活性解析(左、中央)とエラのNa+吸収における役割(右)。
淡水、汽水、海水のいずれの環境においても飼育可能なメフグの腎臓と、海水と汽水でのみ飼育可能なトラフグの腎臓との間には組織構造上の明確な違いが存在します(図3)(Kato et al. BMC Physiol 5(18): 1-11, 2005)。メフグのネフロンは糸球体、近位尿細管、遠位尿細管、集合管の各セグメントで構成されており、その基本構造はゼブラフィッシュなどの淡水魚や、他の広塩性魚類(ウナギ、サケなど)と同じです。一方トラフグのネフロンは糸球体、近位尿細管、遠位尿細管の各セグメントで構成されており、その基本構造は他の狭塩性海水魚と同じです。トラフグとメフグの腎臓における膜輸送体の遺伝子発現を比較からは、Slc12a3 (Na+-Cl- cotransporter, Ncc)の発現に大きな違いが見出されています(Kato et al., Am J Physiol 300: R284-R297, 2011)。Slc12a3は淡水飼育したメフグ集合管の原尿側細胞膜(apical膜)に局在し、海水飼育したメフグ集合管では細胞内に取り込まれます(down regulation)(図4)。これらのことから、Slc12a3は淡水魚腎臓における尿の低張化において重要な役割を担っていると考えられます。
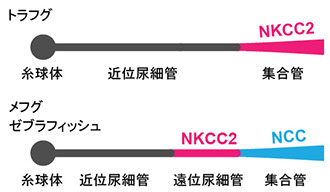
図3 トラフグ、メフグ、ゼブラフィッシュのネフロン構造の比較。メフグはトラフグの近縁種ですが、ネフロンの基本構造はゼブラフィッシュなど他の淡水魚に近いことが分かります。ゼブラフィッシュのネフロンにおける遺伝子発現は Wingertらにより詳細に調べられています(PLoS Genet 3: e189, 2007)。
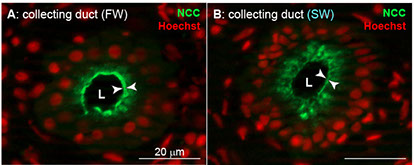
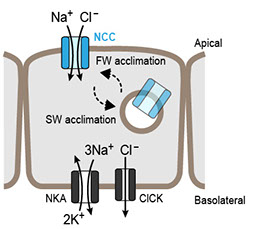
図4 メフグ集合管におけるSlc12a3 (Ncc) の局在。Nccは淡水飼育時は apical膜に局在し、海水飼育時は細胞内にdown regulationされます。
新規 acid loader H+-Cl- 共輸送体の同定
脊椎動物のSlc9ファミリーはNa+/H+ exchanger (Nhe)ファミリーとしても知られる陽イオン交換輸送体のファミリーです。哺乳動物では13の遺伝子から構成され、3つのサブファミリー(Slc9a1~a9, Slc9b1~b2, Slc9c1~c2)に分類する事ができます(Donowitz et al., Mol Aspects Med 34:236‐251, 2013)。またSlc9ファミリーは細菌のNhaA (Na+/H+ antiporter A) と構造上の相同性を有しています。Slc9ファミリーは様々な細胞の酸塩基平衡やNa+代謝において重要な役割を担っています。細胞が生存のためにエネルギーを消費する課程で、細胞内に酸(二酸化炭素、乳酸など)を生じます。細胞内pHの恒常性を維持するために細胞は様々な「acid extruder」を介してH+を細胞外へ排出しますが、Slc9は主要な acid extruderの1つとして重要です(図1)。
Slc9ファミリーの中でSlc9b1~b2, Slc9c1~c2は最近見出されたサブファミリーで、遺伝子産物の膜輸送体としての活性や生理機能があまり良くわかっていません。ショウジョウバエの相同遺伝子の解析から、Slc9b1, b2が高塩濃度耐性に重要な役割を担うことが示されました(Chintapalli et al., Proc Natl Acad Sci USA 112: 11720-11725, 2015)。さらに興味深いことに、アフリカツメガエル卵母細胞に発現させたショウジョウバエSlc9b2は予想通りNa+/H+ 交換輸送活性を示したのに対し、Slc9b1は H+-Cl- 共輸送活性という全く予想外の活性を有することが見出されました(図2)。
この発見には2つの重要な意味があります。第一に、これはSlc9ファミリーによる初めての陰イオン輸送活性の報告となります。ショウジョウバエSlc9b1のH+-Cl- 共輸送活性が特殊な例外でなかった場合、哺乳類や魚類のSlc9ファミリーの中に陰イオン輸送活性を有するメンバーが存在するかもしれません。第二に、H+-Cl- 共輸送活性は熱力学的に acid loader として機能する可能性が高く、他のSlc9ファミリーが一般的に acid extruderとして機能するのと対象的です(図1右)。
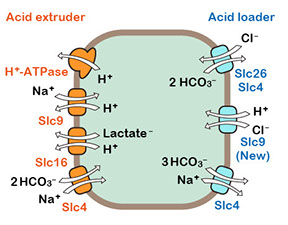
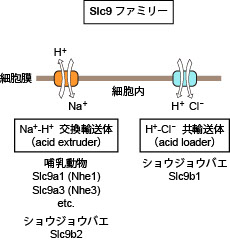
図1 膜輸送体による酸塩基平衡の維持(左)とSlc9ファミリーの役割(右)
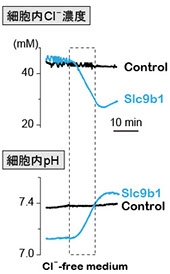
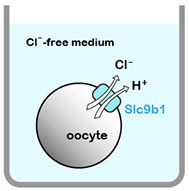
図2 ショウジョウバエSlc9b1によるH+-Cl- 共輸送活性の解析
鰾(うきぶくろ)のガス充てんを担うメカニズム
魚の筋肉や骨格は淡水や海水より比重が大きいため、多くの真骨魚は鰾(うきぶくろ)に気体を蓄えて浮力を維持し、遊泳時の運動量を最小限に節約しています(図1)(Alexander, The Physiology of fishes, 75-97, 1993)。サメや一部の真骨魚類は比重の小さい脂質(スクアレン、ワックスなど)を肝臓や筋肉に蓄えて浮力を維持します。ガスを蓄える鰾は小さなサイズで大きな浮力を得られる利点がある一方、急激な水圧の変化に伴って鰾が大きく膨張・圧縮してしまう欠点もあります。口から取り込んだ空気を鰾に蓄えることができる(開鰾)魚と完全に閉じた鰾(閉鰾)を持つ魚とがおり、水面から遠く深い水深に棲む魚はエラから取り込んだ酸素を鰾の内壁から分泌するため、鰾の内腔に含まれるガス成分のほとんどは酸素です(図2A)。水深1000 m では水圧は100気圧、鰾内の酸素分圧は90気圧にも達しますが、鰾の内壁はその状況下でも酸素ガスを分泌することができます(鰾以外では血液の酸素分圧は0.2気圧ほど)。

図1 魚類の比重調節
高水圧下で酸素ガスを分泌して膨らむ鰾の仕組みはこれまで生理学、組織学、及び生化学的な解析から、魚の血液、鰾内壁、血管に見られる3つの特徴により説明されてきました(Pelster, Physiology 16: 287-291, 2001)。1つ目の特徴は、魚の赤血球に含まれるヘモグロビンがpHの低下に対して非常に敏感に酸素を放出する性質であり、しかもどんなに高酸素濃度の下でも酸素を遊離できる点が哺乳動物とは異なっています(図2C)。この性質はRoot効果と呼ばれています。2つ目の特徴は鰾の薄い膜の腹側の内腔を覆う上皮細胞(ガス腺細胞)に隠されています。「ガスを分泌する細胞」という意味でガス腺細胞と名付けられたこの細胞は活発に血糖(グルコース)を取り込んで嫌気的解糖を行い、乳酸を産生・分泌して鰾膜内の血液をpH 7.0~6.5 にまで酸性化してヘモグロビンから酸素を放出させます(図2B)。3つ目の特徴として、鰾内壁を流れる血液と体循環とを繋ぐ血管が奇網(きもう)と呼ばれる対向流を形成している点が挙げられます(図2B)。鰾の奇網は数十から数百の毛細血管の束からなり、動脈と静脈が交互に並んで対向流を形成します。奇網では動脈が静脈から乳酸や酸素を回収するため、乳酸や遊離した酸素が体循環に流れ出てしまうのを防ぎ、鰾の血液が局所的に高酸素分圧・低pH状態になるのを維持しています。
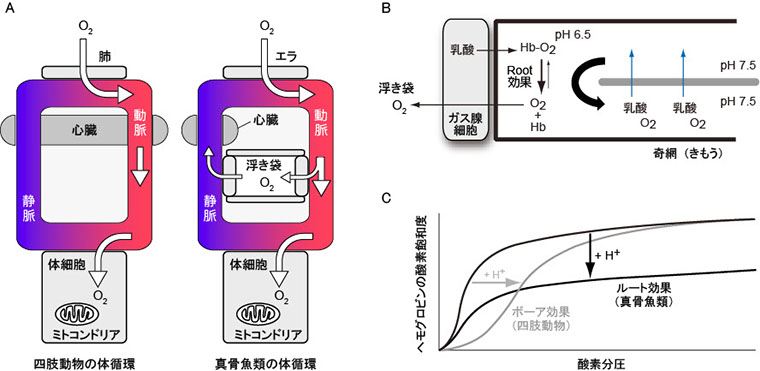
図2 真骨魚類の体循環と鰾(うきぶくろ)による酸素の貯蔵。(A) 四肢動物と真骨魚類の体循環の比較。(B) 鰾内壁による酸素分泌モデル。Hb, ヘモグロビン。(C) 真骨魚類ヘモグロビンのルート効果。
トラフグは発達した閉鰾を有しかつゲノム解読が完了している点で、鰾の機能を担う分子メカニズムの解析に優れています。細胞膜の乳酸輸送を担う輸送体には、H+/乳酸イオン共輸送体(H+/monocarboxylate transporter, MCT, Slc16)とNa+/乳酸イオン共輸送体(Na+/monocarboxylate transporters, SMCT, Slc5)が存在します。トラフグ鰾には、MCT4bとMCT1bの2つの乳酸輸送体が高発現しています(図3J, K)(Umezawa et al., PLoS One 7: e34579, 2012)。MCT4bはガス腺細胞に、MCT1bは奇網の動脈性内皮細胞に発現し、鰾壁を流れる血液の局所的な酸性化に寄与していると考えられます。またガス腺細胞には2種類のグルコース輸送体(GLUT1a, GLUT6)が高発現し、ガス腺細胞による活発なグルコースの取り込み経路となして機能していると考えられます(図3F, G)(Munakata et al., Biochem Biophys Res Commun 417: 564-569, 2012)。
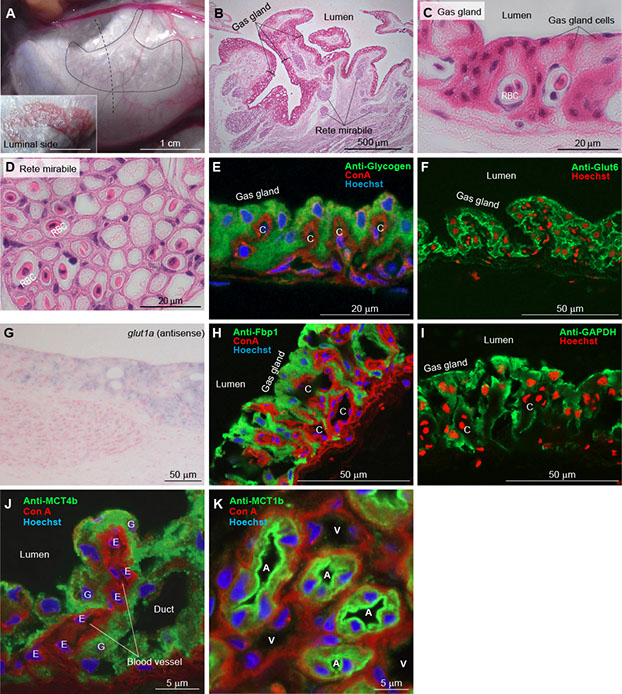
図3 トラフグ鰾(うきぶくろ)の組織染色。(A) 鰾の外面と内面。(B) ヘマトキシリン・エオジン(HE)染色像。(C) ガス腺細胞のHE染色像。(D)奇網のHE染色像。(E, F, H, I, J, K) 抗グリコーゲン、Glut6、Fbp1、GAPDH、MCT4b、MCT1b抗体による免疫染色像。(G) glut1b mRNAの局在(in situ hybridization)。G, gas gland cell; C or E, capillary endothelial cell; A, arterial capillary; V, venous capillary; RBC, red blood cell.
ガス腺細胞はミトコンドリアをほとんど持たず、嫌気的な解糖が非常に活発で、解糖系の酵素を高発現している事が知られています。興味深いことにガス腺細胞には、fructose-1,6-bisphosphatase (FBP1) という酵素も大量に発現しています(図3H)(Munakata et al., Biochem Biophys Res Commun 417: 564-569, 2012)。FBP1は解糖系の逆反応、すなわち糖新生の酵素として知られ、通常は肝臓で乳酸やアミノ酸からグルコースを合成(糖新生)するときに活躍します。糖新生にはミトコンドリアが必用なため、ミトコンドリアのほとんど無いガス腺細胞で糖新生が活発に起きることは考えにくいと言えます。それではFBP1はガス腺細胞内で何をしているのでしょうか?
FBP1の糖新生以外の役割として、マルハナバチの体温保持が知られているます(Newsholme et al., Biochem J 128: 89–97, 1972)。飛行時に羽根を動かす筋肉(飛翔筋)は低い温度では十分な力を発揮できないため、マルハナバチは体温を常に35~40℃に維持しています。花にとまって蜜を集める時に羽根を止めている間に体温が低下するのを防いでいるのがFBP1であると考えられています。解糖とFBP1が同時に細胞内で働くと代謝の空回り(無益回路,futile cycle)が生じてATPが無駄に消費され、熱を生じます。哺乳動物の肝臓には解糖と糖新生が同時に働かないようにする交通整理を行う仕組みが存在するので(Pilkis and Granner, Annual Rev Physiol 54: 885-909, 1992)、ハチの飛翔筋の様な無益回路による発熱は起きません。
魚のガス腺細胞でもマルハナバチの飛翔筋と同様に、FBP1と解糖系が無益回路を形成して発熱している可能性が考えられます(図3)。それではガス腺細胞において無益回路はどの様なメリットがあるのでしょうか?ガス腺細胞において無益回路には2つの重要な役割があると考えられます。1つ目の役割はATPの消費です。乳酸を大量に産生する時に生じたATPはガス腺細胞では副産物的な存在でもあり、もし消費できないレベルのATPが蓄積してしまうと解糖系や乳酸産生を阻害してしまいます。無益回路でATPを消費すればATPの蓄積による解糖系の阻害を回避でき、必要な分だけ乳酸を産生することができるメリットがあります。2つ目の役割は発熱です。鰾内壁では高い酸素分圧が維持されていますが、内腔表面で局所的に酸素の溶解度を下げることができればガスの放出を促進できます。ガス溶解度を下げるためには、溶質の濃度を高めるか温度を上げるかのどちらかが有効です。ガス腺細胞周辺では乳酸濃度が高いことから、高い乳酸濃度がガス溶解度を低下させる可能性がこれまで指摘されてきました。鰾でFBP1が無益回路を形成して発熱しているとしたら、その結果生じる「熱」もガス溶解度の低下に寄与する可能性が考えられます(図4)。
水族館で魚を見ると、魚は「ゆったり」泳いでいます。魚が「ゆったり」泳げるのは鰾のなせる業です。厚さ1 mmほどの鰾の薄い膜にはまだまだ多くの謎が隠されています。
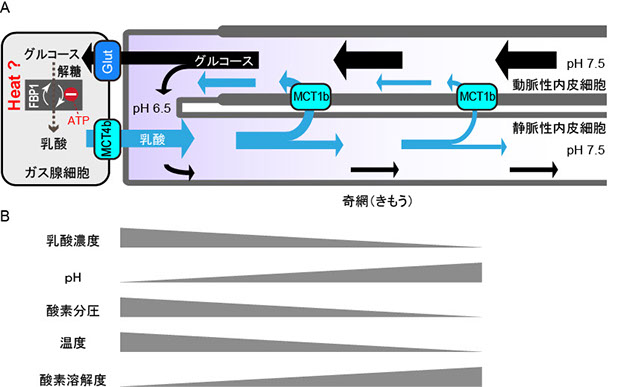
図4 鰾(うきぶくろ)内壁における局所的な血液の酸性化。(A) 乳酸輸送体(MCT)・グルコース輸送体(GLUT)による乳酸・グルコースの輸送経路を示す。奇網の動脈性内皮細胞による選択的な乳酸輸送をMCT1bが担う。ガス腺細胞内では解糖系により乳酸が産生され、局所的にpHが低下する。FBP1は無益回路によるATP消費と熱産生に寄与している可能性が考えられる。(B) 鰾内壁における様々な勾配と予想される温度及び酸素溶解度勾配。
copyright©2016 Kato Laboratory all rights reserved.